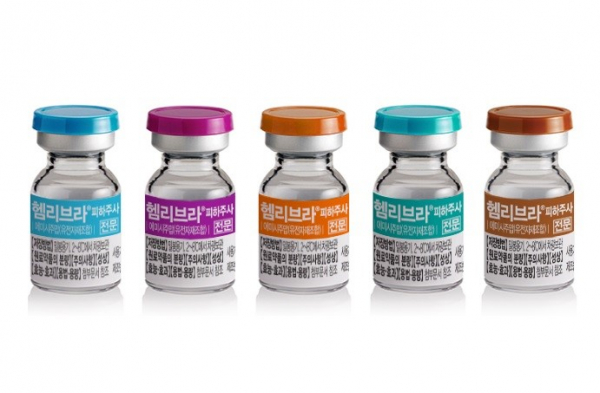
JW중외제약(JW Pharmaceutical)은 국내 중증 A형 혈우병 비항체 소아환자를 대상으로 FIXaxFX 이중항체 ‘헴리브라(Hemlibra, emicizumab)’의 약효와 안전성을 입증한 첫 연구 결과가 국내 혈액학회지 ‘블러드 리서치(BLOOD RESEARCH)’에 게재됐다고 28일 밝혔다.
헴리브라는 로슈(Roche)가 개발한 A형 혈우병 치료제로, 지난 2017년 미국 식품의약국(FDA)으로부터 시판허가를 받았다. JW중외제약은 지난 2017년 로슈로부터 헴리브라의 국내 판매에 대한 독점적인 라이선스를 들여왔다.
이전까지 해외 연구에서 헴리브라의 소아환자 대상 출혈 감소 효과가 입증된 바 있지만, 국내 환자의 실제 처방 데이터(Real-World data)를 바탕으로 한 연구결과는 이번이 처음이다.
헴리브라는 A형 혈우병 환자의 몸에 부족한 혈액응고 제8인자를 모방하는 기전의 혁신신약으로, 혈액응고 제9인자와 제10인자에 동시 결합하는 이중특이항체(Bispecific antibody) 기술이 적용됐다. 특히 헴리브라는 A형 혈우병 치료제 중 유일하게 기존 치료제(제8인자 제제)에 대한 내성을 가진 항체 환자뿐만 아니라 비항체 환자 모두 사용할 수 있다. 최대 4주1회 피하주사로 예방 효과가 지속되는 특징도 있다.
김성은 경북대병원 소아청소년혈액종양과 교수 연구팀은 2020년 6월부터 올해 3월까지 0~11세 중증 A형 혈우병 비항체 환자 21명을 대상으로 연구를 진행했다. 연구팀은 이들 환자에게 6개월 이상 헴리브라를 투여한 뒤 연평균 출혈빈도(ABR, Annual Bleed Rate)와 연평균 관절 출혈빈도(AJBR, Annual Joint Bleed Rate)를 측정했다.
연구 결과 환자들의 ABR은 기존 7.04회에서 헴리브라 투약 후 0.41회로 감소됐다. AJBR은 2.28회에서 0.21회로 유의미하게 줄었다. 특히 18명의 환자는 헴리브라 투약기간 동안 단 한 번도 출혈을 경험하지 않았다. 안전성 측면에서는 심각하거나 생명을 위협하는 부작용을 비롯해 혈전색전증, 전신 과민반응 등도 나타나지 않았다.
JW중외제약 관계자는 “이번 연구는 국내 소아 환자 대상 실제 처방 데이터로 헴리브라의 약효와 안전성을 처음 확인했다는 점에서 의미가 크다”며 “헴리브라를 통해 A형 혈우병 환자들의 삶의 질이 개선되길 기대한다”고 말했다.



![[단독] "AI에 진심" 정태영 부회장, '유니버스' 중동 세일즈 나섰다](https://img.etoday.co.kr/crop/140/88/1970536.jpg)
![[종합]'금융 컨트롤타워 재확인' 강한 리더십 통했다[김병환號 100일]](https://img.etoday.co.kr/crop/140/88/2097645.jpg)



![요동치는 비트코인, 매크로 이슈 속 6만8000달러 선 지지 [Bit코인]](https://img.etoday.co.kr/crop/140/88/2097821.jpg)













![[찐코노미] ‘D-1’ 美 대선, 초박빙…글로벌 금융시장도 긴장](https://img.etoday.co.kr/crop/300/170/2097489.jpg)
![달러 강세에 지난달 외환보유액 42억8000달러 감소 [포토]](https://img.etoday.co.kr/crop/300/190/2097855.jpg)