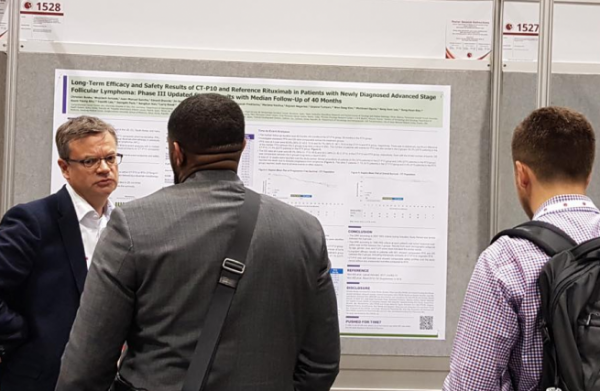
셀트리온은 7일(현지시간)부터 미국 플로리다 올랜도에서 개막한 2019 미국혈액학회(The American Society of Hematology, ASH 2019)에서 혈액암의 일종인 여포성 림프종 환자(Advanced Follicular Lymphoma, AFL)를 대상으로 진행한 트룩시마 임상 3상 장기 추적 결과를 발표했다.
이번 연구는 AFL 환자 140명을 대상으로 각각 트룩시마와 리툭산을 투여해 임상을 진행했으며, 40개월 중앙 추적 관찰 기간 결과 트룩시마의 전체 생존율(OS, Overall Survival) 및 무진행 생존율(PFS, Progress-Free Survival), 종양 진행 소요 기간(TTP, Time To Progressive)이 오리지널 의약품과 유사했다.
트룩시마 및 리툭산 치료를 받은 환자들의 4년째 전체 생존율(OS) 추정값은 각각 88.0%, 93.3%, 종양의 진행이나 사망 없이 환자가 생존할 확률을 뜻하는 무진행 생존율(PFS)은 각각 60.9%, 54.7%, 무작위 배정부터 종양 진행 소요 기간을 뜻하는 종양 진행 소요 기간(TTP)은 각각 64.2%, 60.9%였으며, 통계적 검증을 통해 트룩시마의 효능과 안전성이 전체 임상 기간 동안 오리지널 의약품과 유사한 것을 확인했다.
크리스티안 부스케(Christian Buske) 독일 울름 대학병원(Comprehensive Cancer Center Ulm) 혈액종양내과 교수는 "이번 임상은 리툭시맙 바이오시밀러의 장기 임상 결과를 최초로 발표하는 데 의미가 있다"면서 "트룩시마와 오리지널 의약품 사이 장기 유효성과 안전성 유사성이 입증된 만큼, 향후 트룩시마 처방에 대한 의사들의 신뢰가 한층 더 높아짐에 따라 처방 확대가 기대된다"고 말했다.
셀트리온 관계자는 "이번 임상은 독일, 스페인, 러시아 등 유럽과 인도, 일본 등 아시아 지역 환자를 대상으로 40개월에 걸친 다국적 장기 임상이 진행돼 트룩시마의 효능과 안전성을 검증했다"면서 "독보적인 의학적 검증을 토대로 트룩시마는 전세계 혈액암 환자의 의료 복지 향상은 물론 경제적 부담 완화에 크게 기여할 것"이라고 말했다.
한편 트룩시마는 지난달 세계 최대 의약품 시장인 미국에 북미 지역 유통 파트너사인 테바(TEVA)를 통해 정식 출시됐다.트룩시마는 연 5조원 규모의 미국 시장에 가장 먼저 진출한 리툭시맙 바이오시밀러로서, 이같은 '퍼스트 무버(First mover)' 강점을 통해 미국 시장을 빠르게 선점해 나갈 계획이다.

![최장 10일 연휴…내년 10월 10일 무슨 날? [데이터클립]](https://img.etoday.co.kr/crop/140/88/2097539.jpg)
![사생활부터 전과 고백까지…방송가에 떨어진 '일반인 출연자' 경계령 [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2097516.jpg)


![전남 ‘폐교’ 844곳 가장 많아...서울도 예외 아냐 [문 닫는 학교 4000곳 육박]](https://img.etoday.co.kr/crop/140/88/2096215.jpg)
![[종합] 금투세 소멸에 양대 지수 급등 마감…외인·기관 코스닥 ‘쌍끌이 사자’](https://img.etoday.co.kr/crop/140/88/1961259.jpg)
!["성냥갑은 매력 없다"…정비사업 디자인·설계 차별화 박차 [평범한 건 NO, 특화설계 경쟁①]](https://img.etoday.co.kr/crop/140/88/2096997.jpg)
![[단독] '부정‧부패' 의혹 장애인아이스하키협회, 상위기관 중징계 처분 뭉갰다](https://img.etoday.co.kr/crop/140/88/2095914.jpg)













![[찐코노미] ‘D-1’ 美 대선, 초박빙…글로벌 금융시장도 긴장](https://img.etoday.co.kr/crop/300/170/2097489.jpg)
![서울시립 김병주도서관 착공식 현장 나서는 김병주 MBK 파트너스 회장 [포토]](https://img.etoday.co.kr/crop/300/190/2097597.jpg)